近年來,我校化學學院陳莉教授團隊圍繞生物醫用高分子材料在納米藥物遞送方面的應用,針對生物醫用高分子材料遞送藥物應用中存在的體內運輸穩定性、腫瘤部位靶向性、復雜生理環境穩定性不足等關鍵科學問題開展研究,取得了系列重要科研成果。
團隊首次利用聚乙烯醇-縮醛化葡聚糖雙親水性嵌段共聚物構建納米膠束并作為藥物載體,調控納米藥物載體組裝行為、與細胞相互作用、藥物釋放行為(ACS Appl Mater Inter 2013, 5,10760);通過調控聚合物鏈段組成,基于非共價鍵超分子作用構建了適應復雜生理環境的納米藥物載體,利用苯并咪唑與環糊精的主客體識別作用,制備腫瘤微環境響應性超分子嵌段共聚物,合成方法簡便、性能調控方便(Polym Chem, 2013, 4, 3265;Chem Commun, 2014, 50, 3789);利用靜電相互作用構建腫瘤微環境響應性碳酸鈣交聯透明質酸納米遞送系統的新策略,有效遞送化療藥物,提高藥物在血液中的穩定性,增強在腫瘤中的靶向富集,有效治療不同階段骨肉瘤(Nano Research 2018, 11: 4806);利用金屬配位作用構建 pH 響應性納米遞送系統的新策略,建立不同藥物之間共同作用的新方法,解決聯合治療藥物共載難題,顯著增強聯合治療效果(Acta Biomater 2015, 25, 162;J Mater Chem B, 2015, 3, 4707),借助腫瘤細胞微環境的改變,實現了藥物的靶向遞送和可控釋放,有效提高了藥物的溶解度、穩定性和腫瘤靶向性,增強了腫瘤治療效果,為尋求對腫瘤細胞有特異選擇性的高效抗腫瘤制劑奠定了基礎。
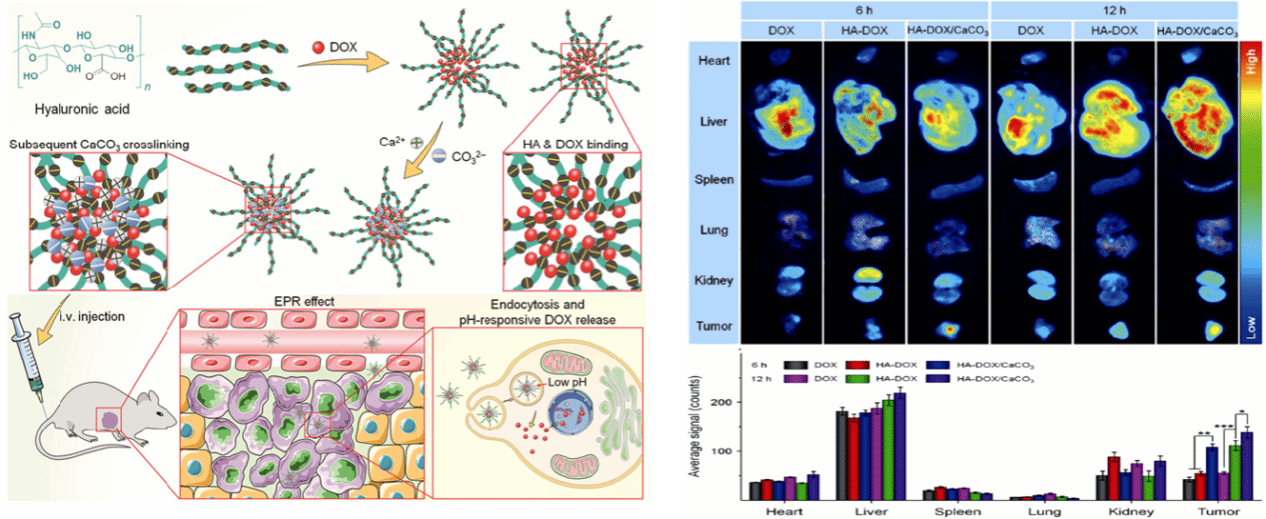
圖1. HA-DOX/CaCO3的制備、靜脈注射、體內循環、在腫瘤組織中的選擇性富集和pH觸發的細胞內藥物釋放的示意圖。
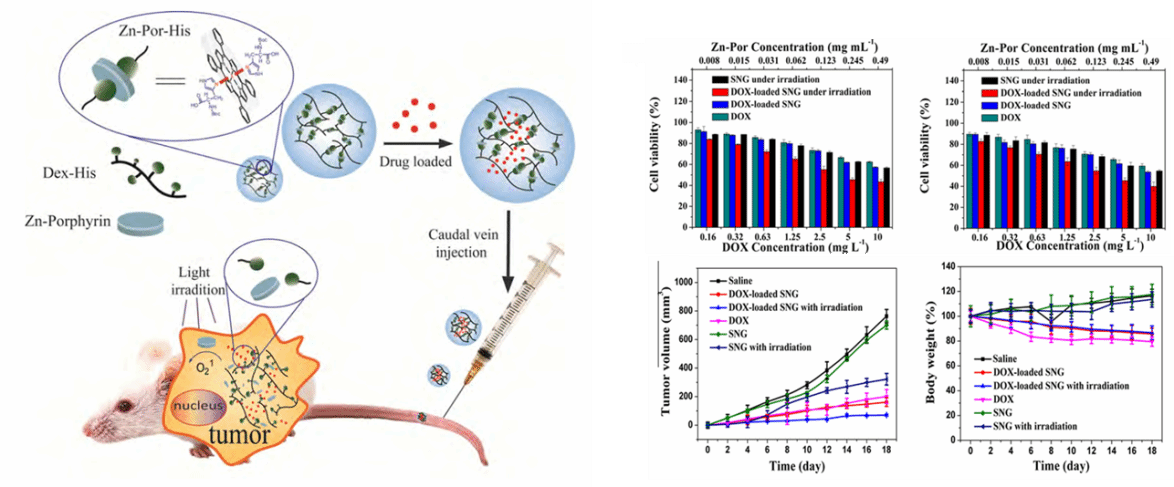
圖2. pH響應性金屬超分子納米凝膠用于腫瘤化療-光動力協同治療;不同濃度Zn-Por、MSN、DOX-loaded MSN、DOX的細胞存活率及腫瘤體積和老鼠體重隨時間變化圖
團隊先后在Biomaterials, Acta Biomater., Chem Commun等化學、生物材料與藥物遞送領域有國際影響力學術刊物上發表系列有代表性的文章;培養博士畢業生7名,相關科研成果與中國科學院長春應用化學研究所聯合申報獲得2023年度吉林省科學技術獎自然科學獎二等獎。