東北師范大學藥物基因和蛋白篩選國家工程實驗室(以下簡稱“實驗室”)是2008年國家發展和改革委員會在生物技術領域首批建立的十個國家工程實驗室之一�。近年來��,實驗室主要針對免疫相關疾病,如惡性腫瘤�、自身免疫病�、代謝性疾病等進行藥靶篩選鑒定及新藥研發���,相關成果相繼發表在Journal of Advanced Research(2024), Cell Chemical Biology (2023), Small (2023)����,Signal Transduction and Targeted Therapy (2022), Biosensors and Bioelectronics (2022)等期刊上。近日��,實驗室的相關研究更是取得重要進展����。
實驗室趙永云研究員課題組聯合四川大學宋旭教授課題組,在靶向“難以成藥”靶點的藥物研發領域取得新進展——
良好的藥物靶點是發現性質優良藥物的前提和基礎��,選擇合適的靶點可以提高藥物的療效�����、降低副作用����。與人體疾病相關的致病蛋白中�,超過80%的靶蛋白難以通過常規的方式靶向,這類靶點被稱為“不可成藥”靶點�����,主要原因是這類蛋白缺乏一個易于識別的可接近的口袋(結合位點)�����,難以篩選有效藥物。長期以來,不可成藥靶點的藥物研發是當前藥物研究領域的一大挑戰。
課題組致力于多功能核酸分子的開發,其中作為“化學抗體”的核酸適配體具有對靶標無要求的特殊優勢,提示核酸適配體是解決“不可成藥”靶點配體缺乏的有力工具���。據此,課題組針對當前三大不可成藥靶點之一的無序結構蛋白c-Myc,體外篩選靶向結合c-Myc的核酸適配體�����,并以其為配體���,化學偶聯E3泛素連接酶的配體���,設計開發了靶向降解c-Myc的核酸降解劑(ProMyc)(圖1)�����。ProMyc不僅可通過泛素蛋白酶體途徑顯著降解c-Myc蛋白��,同時也降解了與其形成異源二聚體的Max蛋白,協同抑制其轉錄活性,提升了藥效。為提高ProMyc的成藥性�,利用課題組前期自主開發的DNA環化的穩定體系和依賴核酸適配體的靶向遞送系統�����,解決核酸穩定性和靶向遞送問題,在異種移植腫瘤模型小鼠中顯著抑制了腫瘤的發生發展,為開發臨床有效的c-Myc降解劑奠定了堅實的工作基礎�����。此工作基于核酸適配體開發靶向降解劑�����,為解決不可成藥靶點缺乏有效配體的問題提供了新思路�,為“難以成藥”靶點的藥物研發提供了一種極具前景的藥物發現途徑���。相關研究成果以“Antitumor Effect of Anti-c-Myc Aptamer-Based PROTAC for Degradation of the c-Myc Protein”為題于2024年4月發表于國際學術期刊《Advanced Science》上���。實驗室趙永云研究員和四川大學宋旭教授為本文共同通訊作者��。
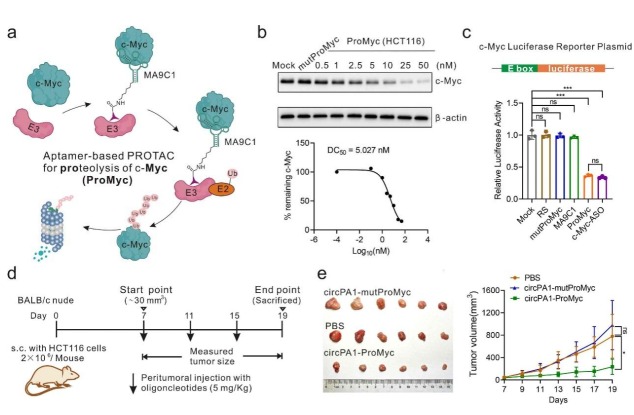
圖1. ProMyc對c-Myc蛋白的靶向降解能力和抗腫瘤活性評價
實驗室鮑永利教授��、宋振波副教授課題組在炎癥性腸病(IBD)藥靶鑒定方面取得重要進展——
炎癥性腸病(IBD)�����,包括克羅恩?��。–D)和潰瘍性結腸炎(UC)����,是全球性的慢性疾病,近年來其發病率不斷上升且無良好的治愈方法����,給患者帶來了較大的健康困擾��。目前IBD尚無有效的治療靶點。
課題組發現原癌基因睪丸特異性蛋白酶50(TSP50)在IBD發生中發揮重要作用���,TSP50缺乏小鼠在DSS誘導下表現出更嚴重的結腸炎癥狀,包括體重迅速下降和死亡率增加���。進一步的機制分析表明,TSP50的缺乏導致腸道干細胞(ISCs)中TGF-β信號通路的異常激活�,阻礙了小鼠腸道中杯狀細胞的分化��,從而損害了粘膜的屏障功能����,促進了腸道細菌與腸上皮之間的直接接觸,從而增加了對結腸炎的易感性(圖2)�����。該研究為IBD的治療提供了新的靶點�����。相關研究成果以“TSP50 Attenuates DSS-Induced Colitis by Regulating TGF-β Signaling Mediated Maintenance of Intestinal Mucosal Barrier Integrity”為題于2024年3月發表于國際學術期刊《Advanced Science》上����。實驗室宋振波副教授���、鮑永利教授為本文共同通訊作者�。生命科學學院李嘉瑋博士、鈕春雪博士�����、艾慧涵博士為本文共同第一作者��。
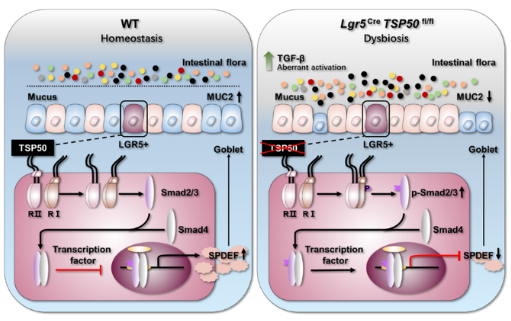
圖2.TSP50通過TGF-β信號調控腸黏膜屏障模式圖
文章鏈接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202309639
文章鏈接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202305893